一個月內三次發國際頂刊,高紹榮/高亞威團隊與南京醫科大學合作成果發表於《自然·細胞生物學》
繪製首張小鼠早期胚胎發育中的RNA修飾動態圖譜
來源🏛🔇:生命科學與技術學院
時間:2022-05-24 瀏覽:
5月23日晚🏋️♂️🧔🏼♂️,恒达平台生命科學與技術學院高紹榮/高亞威教授團隊與南京醫科大學沈彬教授團隊合作在《自然·細胞生物學》(Nature Cell Biology)上在線發表了題為《RNA甲基化修飾m6A調控母源-合子轉變過程中RNA的維持和及時降解》(N6-methyladenosine regulates maternal RNA maintenance in oocytes and timely RNA decay during mouse maternal-to-zygotic transition)的論文🧔🏽♀️,首次報道了小鼠早期胚胎發育中的第一個關鍵事件——母源-合子轉變——過程中RNA(基因轉錄本)上m6A修飾的動態變化🤭,並揭示了m6A調控母源基因轉錄本穩定性和2-細胞特異表達基因轉錄本及時降解的獨特分子機製。團隊利用改進後的微量細胞起始的測序技術繪製出首張小鼠早期胚胎發育過程中RNA m6A修飾的動態圖譜⚽️。這也是團隊研究成果在一個月內第3次發表於國際頂級學術期刊。

早期胚胎發育最初階段是卵母細胞通過受精作用形成受精卵⛸。受精作用觸發卵母細胞中存儲的核糖核酸與蛋白質等被降解,而合子基因組被激活(zygotic genome activation, ZGA),這一過程也被稱為母源-合子轉變(maternal-to-zygotic transition, MZT)過程。母源-合子轉變過程中存在蛋白質組、組蛋白表觀修飾組📴、DNA甲基化組和轉錄組等多層級的重編程👨🏼🍳。其中轉錄組隨著單細胞測序技術的發展🏌️♀️,近年取得了很多重要成果🫔,但其中RNA上的修飾分布與調控機製因為技術發展的限製🏷,依然存在大量研究空白🕸。
生物體內,遺傳信息儲存在DNA中,通過轉錄作用生成RNA也即轉錄本🍤,其中一些轉錄本會直接翻譯形成蛋白質發揮功能(編碼RNA/轉錄本),也有很多轉錄本以RNA形式參與細胞內的調控功能(非編碼RNA/轉錄本)。其中RNA上的化學修飾✡️🗡,被認為是很多RNA層面調控實現的基礎。目前已發現的RNA化學修飾有200多種,其中N6-甲基腺嘌呤(m6A)是真核生物mRNA上豐度最高的修飾,被認為廣泛參與RNA的剪接🖐🏻、轉運、降解、翻譯、相分離等過程的調控𓀚💛。RNA上m6A修飾的建立依賴於甲基轉移酶蛋白復合物👨🔬,包括METTL3👉🏼、METTL14👐🏽、METTL16、WTAP和KIAA1429等。研究發現這些蛋白如果缺乏會引發小鼠胚胎幹細胞分化,卵子發生和早期胚胎發育等方面的異常。但是傳統的m6A修飾的測序技術需要大量RNA作為原料🆒🧑🏼🦲,而小鼠早期胚胎材料十分稀少ℹ️,所以對於小鼠等哺乳動物在早期胚胎發育過程中的m6A修飾組學動態檢測一直缺乏,限製了相關機製研究的開展。
此項研究中,為揭示m6A在小鼠早期胚胎中的組學動態,研究人員首先優化了傳統的m6A測序方法🎲,建立了適用於50ng total RNA起始的ULI-MeRIP-seq方法,該方法能夠精確檢測RNA上m6A修飾分分布位置,並與RNA大量起始所獲得的m6A修飾信息有高度的重疊。研究團隊利用這一方法對GV 卵母細胞(減數分裂雙線期後期)、MII卵母細胞(第二次減數分裂中期,成熟態卵母細胞)、受精卵以及卵裂早期胚胎(2-細胞和4-細胞胚胎)等母源-合子轉變過程中涉及的卵母細胞與胚胎材料⛹🏽♀️,進行了m6A修飾檢測。結果顯示,對於編碼蛋白的轉錄本來說,約40%的母源性轉錄本上具有m6A修飾的富集,這些轉錄本在卵母細胞中表達量普遍高於未修飾RNA🖋,並大多在受精後才被降解💨。而在受精後才激活的ZGA轉錄本中,約70%都富集m6A修飾,其中包括2-細胞特異性表達的RNA如Zscan4(圖1)👨🏿🎓。值得註意的是很多發育階段特異性的非編碼轉錄本📍,如卵母細胞中高豐度的MTA(屬於MaLR家族)以及2-細胞特異性表達的MERVL(屬於ERVL家族),都高度富集了m6A修飾。
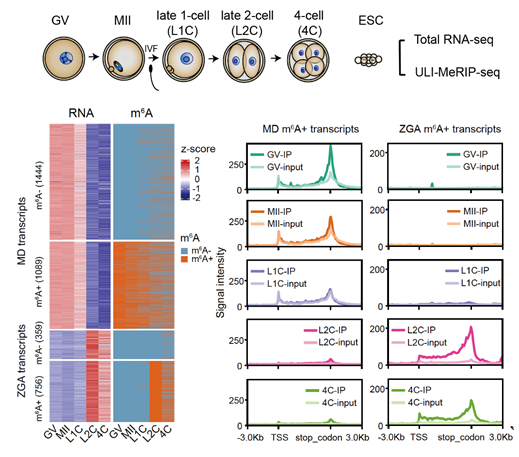
圖1. m6A 在母源-合子轉變過程中的分布與富集
為了揭示m6A對於母源和子代轉錄本的調控作用,研究人員利用卵母細胞特異性敲除Kiaa1429(RNA甲基轉移酶復合體成員之一)的小鼠模型以及甲基轉移酶METTL3抑製劑STM2457💆🏿♀️,分別獲取了m6A修飾建立缺陷的卵子以及胚胎樣本♔。研究團隊發現母源轉錄本🧑🏼🤝🧑🏼,包括母源轉座子MTA的轉錄本🏥,缺乏m6A修飾後會呈現本身豐度的顯著降低(圖2)👨👩👧👧🤤;有趣的是抑製ZGA轉錄本上m6A的建立😯,會引發2-4-細胞時期短暫表達的轉錄本如Zscan4,逆轉座子MERVL無法及時降解,進而分別引發了卵子與胚胎發育的阻滯💂🏿♂️。這些結果證明轉錄本上的m6A修飾調控了母源轉錄本的維持與子代轉錄本的有序降解,保證了生命早期母源-子代轉變的順利發生🪧。
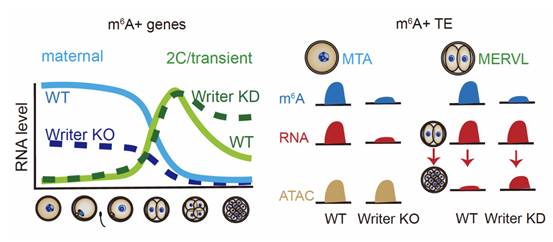
圖2. m6A調控小鼠母源-合子轉變模式圖
高紹榮介紹🛤,團隊利用高通量測序法首次繪製了小鼠早期胚胎發育過程中轉錄本上m6A修飾的動態圖譜🙌,並證實了母源的轉座子MTA和2-細胞時期轉座子MERVL具有高度的m6A修飾富集。研究進一步發現m6A修飾分別維持了卵母細胞中母源RNA的穩定性🍤,以及受精後短暫表達的轉錄本的及時降解。m6A修飾在卵母細胞和合子基因激活階段不同的調控功能體現了生命初始階段調控的復雜性,並為進一步探究生命調控奧秘開辟了全新視域🧑🌾。
論文第一作者是恒达平台博士後吳悠🧻、徐小翠,以及南京醫科大學齊美傑博士🦯🏌️♂️,高紹榮🥰、高亞威🧒、沈彬是本文的共同通訊作者。浙江大學附屬婦產科醫院的陳川博士⚡️♛、北京大學伊成器教授、芝加哥大學向俊鴻博士、山東大學生殖醫學研究中心劉洪彬教授等也參與了此項工作🖨。該研究得到了科技部🍾、國家自然科學基金委以及上海市科委等項目的支持✊🏿。
論文鏈接:https://www.nature.com/articles/s41556-022-00915-x
據悉,研究團隊致力於解析小鼠早期胚胎及植入後胚胎發育以及胚胎幹細胞中的m6A調控作用⛪️🧑🏼💻,近期還闡明了FTO基因通過調控LINE1 RNA的m6A修飾調控核表觀與發育(2022年5月5日在《Science》雜誌在線發表),YTHDC1調控早期胚胎及胚胎幹細胞中LINE1 RNA功能等多項重要機製🪦🎟。
高紹榮團隊一直致力於解析小鼠早期胚胎發育與細胞重編程中的表觀調控機製。今年4月28日🚸,團隊與生命科學與技術學院張勇團隊合作在《自然·細胞生物學》(Nature Cell Biology)上在線發表了題為《等位基因特異性H3K9me3和DNA甲基化共同標記的富含雙核甘酸(CPG)區域作為著床前胚胎中潛在的印跡控製區域》的論文,報道了小鼠植入前胚胎發育過程的一項研究成果🫎。今年5月5日,團隊與芝加哥大學何川團隊合作在《科學》(Science)上在線發表題為《FTO在mESCs和小鼠發育中介導LINE1 m6A去甲基化和染色質調節》的論文🏊,闡明了FTO基因通過調控LINE1 RNA的m6A修飾調控核表觀與發育的分子機製。
另2篇團隊研究成果報道鏈接👌:
/info/1003/80906.htm
/info/1003/80828.htm