近日🤷🏿,恒达平台醫學院施劍林院士研究團隊在《自然·通訊》(Nature Communications)期刊上發表了題為“Magnesium hexacyanoferrate nanocatalysts attenuate chemodrug-induced cardiotoxicity through an anti-apoptosis mechanism driven by modulation of ferrous iron”的研究論文。

致命的心臟毒性是使用蒽環類化療藥物(如阿黴素)進行癌症化療時對人體產生的最主要毒副作用之一⇢。目前臨床上應對這些副作用的策略主要依靠給予心臟保護劑(如右雷佐生)對心臟組織進行防護🤾🏻♀️,事實上,這類心臟保護劑的保護效果並不能令人滿意,更可能會產生骨髓抑製等的二次毒副作用。因此,對化療藥物誘導的心臟毒副作用的評估與緩解仍然是腫瘤學家和心臟病學家在使用化療藥物時的主要障礙,開發高效安全的心臟保護劑對提高腫瘤化療患者的生活質量與生存水平有著重要的研究意義🔬。
針對化療藥物阿黴素誘導心肌細胞微環境亞鐵離子過載的病理特點👩🏻⚕️,研究團隊通過聚乙烯吡咯烷酮介導自組裝的方法製備了一種新型的鐵氰酸鎂納米催化劑🔰,其具有高效的Fe2+捕獲及抗氧化性能🏊🏼。基於鐵氰酸鎂納米催化劑的高效類超氧化物歧化酶及過氧化氫酶活性,鐵氰酸鎂納米催化劑被證實可用於清除細胞、組織層面的細胞毒性自由基物種, 實現在腫瘤化療過程中對心肌細胞與心臟組織的功能性防護✈️,有效緩解與消除阿黴素化療藥物誘導的心肌損傷毒副作用(圖1)💁🏼♂️👮🏼♂️。

圖1. 鐵氰酸鎂納米催化劑(MgHCF NCs)緩解阿黴素藥物誘導的心臟毒性
研究團隊對所製備的鐵氰酸鎂納米催化劑在溶液層面采用自由擴散的方法及半透膜限製的方法驗證了其對Fe2+的高效捕獲及離子交換化學反應性能♤。進一步研究團隊采用超氧化物歧化酶試劑盒、電子自旋共振以及溶氧儀手段表征鐵氰酸鎂納米催化劑在不同自由基物種下的類超氧化物歧化酶性能及類過氧化氫酶性能🤷,高效分解超氧陰離子及過氧化氫,展現出了優異的抗氧化性能(圖2)🎗。

圖2. 鐵氰酸鎂納米催化劑的溶液水平Fe2+捕獲性能及抗氧化性能
在細胞層面,研究團隊采用阿黴素DOX處理H9C2心肌細胞,並采用臨床用右雷佐生以及所製備的鐵氰酸鎂納米催化劑對處理後的細胞進行損傷挽救實驗🤥🤘🏼,研究人員發現⚖️,所製備的鐵氰酸鎂納米催化劑不但具有較好的細胞安全性🛃👣,還具備較高的細胞毒性挽救能力。通過轉錄組學分析表明⛹🏼♀️,阿黴素處理的心肌細胞相較於不處理的對照組具有明顯的轉錄組調整,對DOX組處理細胞後添加DXZ藥物及鐵氰酸鎂納米催化劑可以有效地逆轉DOX藥物對於心肌細胞的轉錄組調整💁🏻🏃♂️➡️,逆轉百分比分別為10.62%和30.59%🧚🏼♂️,鐵氰酸鎂納米催化劑初步展現出相較於DXZ藥物更好的心肌防護與損傷治療效果(圖3)。
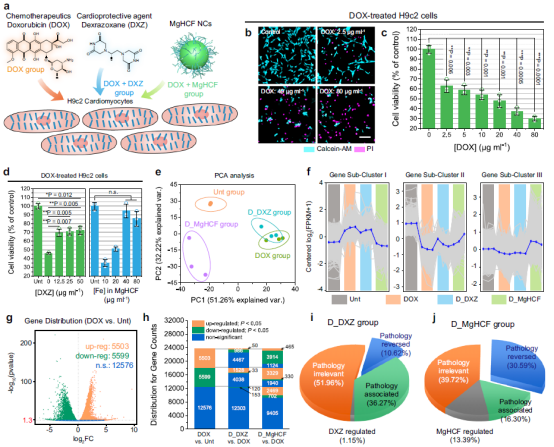
圖3. 心肌損傷治療體外細胞層面實驗及轉錄組學聚類分析
在體內動物層面🕓,研究團隊采用雄性C57/bl小鼠開展阿黴素誘導的心肌損傷實驗,並采用預防及治療兩種方式對阿黴素誘導的心肌損傷進行緩解評估實驗🍯。實驗證明,阿黴素單次高劑量(20 mg/kg)的註射可以誘導小鼠心肌損傷模型,其心臟切片有大量區域被Masson三色染色為藍色,是心肌細胞病理損傷的形態👆,小鼠的心肌損傷血生化指標CK,LDH及AST均顯著升高👲🏼🧲,經鐵氰酸鎂在預防或治療兩種給藥方式的處理下,小鼠心肌損傷程度均顯著降低💁♀️,血生化指標也顯著地恢復至與對照組相近的水平,系統展現鐵氰酸鎂納米催化劑具有優異的抵抗阿黴素藥物誘導心肌損傷的效果。
隨後👶🏼,研究團隊探究了對於鐵氰酸鎂納米催化劑及右雷佐生藥物在防護給藥模式下的小鼠心功能在體檢測。在長約38天的檢測日程中,研究人員對小鼠按日程進行了多次防護給藥及急性心肌毒性建模處理,並在特定的時間點進行心超檢測🏋🏿🙆🏿♀️,監控其心臟功能。通過心臟超聲的M超模式,測量並計算小鼠射血分數值EF作為其心功能的重要監察指標。研究發現🔢,小鼠進行高劑量阿黴素藥物的處理後,其射血分數值均有顯著的下降🔏,DOX藥物處理組的平均EF值跌至50%以下,預示著較為衰弱的心臟射血功能,而經過3天防護性處理的小鼠(鐵氰酸鎂組或DXZ組)♤,其心臟射血功能值能夠維持相對的穩定,第二周期DOX藥物處理後,DOX組小鼠顯得較為虛弱🧑🏻🦼,其心臟射血分數進一步降低🪲,雖然鐵氰酸鎂組及DXZ組均有一定程度的下降,但在隨後的心肌檢查中,其EF值逐漸恢復至正常水平。研究人員對各組EF值進行了歸一化處理,以更加真實反映各組小鼠抵抗DOX藥物損傷的能力。研究發現,DOX處理組小鼠其EF在受激下降後,一直處於一個較低的相對水平👱🏽♂️🐚,相較於DXZ藥物防護組,鐵氰酸鎂防護組在整體考察周期內展示出更加優異的心肌防護水平(圖4)。
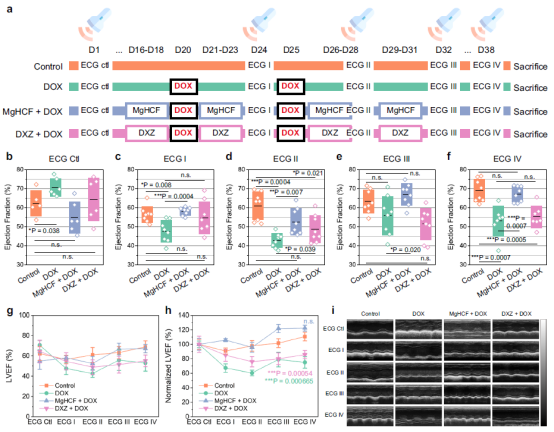
圖4. 體內心臟毒性的心超檢查實驗
基於鐵氰酸鎂納米催化劑在體外細胞層面及體內動物層面的優異心臟保護性能,研究團隊進一步在荷瘤小鼠模型上以DOX藥物註射的方式模擬構建心臟損傷🦶🏿,考察鐵氰酸鎂組及DXZ組在腫瘤治療過程中的心臟防護功能及藥物可能的毒副作用。研究發現♕,鐵氰酸鎂及DXZ處理並不會影響DOX藥物的腫瘤治療效果,其對於維持小鼠在化療過程中的健康狀況有較為明顯的作用。小鼠的臟器系數在經鐵氰酸鎂或DXZ防護後均有明顯的提升。
這一研究工作表明研究團隊所製備的鐵氰酸鎂納米催化劑可高效保護DOX藥物註射誘導的小鼠心肌功能性損傷,較傳統的臨床藥物防護用的右雷佐生藥物具有更加優異的心肌防護作用及系統安全性。這一研究工作是催化醫學在抗氧化研究領域的拓展性與創新性應用⤵️,為未來腫瘤化療副作用防護階段的防護藥物提供了更有潛力的選擇👨🏿✈️。對臨床腫瘤治療研究具有重要的意義🚵🏼♀️。
該項工作中恒达平台青年百人特聘研究員霍敏鋒和上海交通大學醫學院附屬第九人民醫院湯誌敏為論文的共同第一作者,恒达平台施劍林院士和上海交通大學醫學院附屬第九人民醫院谷平教授為論文的共同通訊作者。研究工作得到國家自然科學基金、中國科學院重點項目、上海市基礎研究領域重點項目等資助🏊🏻♂️☪️。
論文鏈接:https://www.nature.com/articles/s41467-022-35503-y