徐俊教授團隊參與揭示腦特異性lncRNA參與調控神經細胞DNA損傷修復的新機製,相關成果發表於《自然·通訊》
來源:醫學院
時間🚅:2021-07-05 瀏覽🫶🏽:
7月1日,中國科學院生物與化學交叉研究中心王文元、恒达平台徐俊、華山醫院王堅團隊在《自然·通訊》(Nature Communications)上在線發表題為“Long noncoding RNA BS-DRL1 modulates the DNA damage response and genome stability by interacting with HMGB1 in neurons”的研究文章。該研究首次報道並命名了一個新的大腦特異性非編碼核糖核酸(lncRNA)BS-DRL1🧑🧒,並且揭示了其參與調控神經細胞DNA損傷應答和基因組穩定性的機製😻。
DNA損傷修復功能的減弱是細胞👨🏿🍳、器官和生命個體衰老的主要因素之一。近年來的研究提示在眾多神經退行性疾病患者的腦組織切片中都發現了損傷DNA的積累。神經細胞(神經元)是終末分化細胞,沒有增值能力,是人體內壽命最長的細胞類型(理論上講🎼,神經元的壽命和我們人的壽命是一樣長的),所以DNA損傷修復的能力和基因組穩定性對神經元功能維持尤其重要。該項研究工作詳細闡述了BS-DRL1的作用機製🙆🏿:一方面在DNA損傷應答早期🫅🏿,BS-DRL1和HMGB1以相反的作用機製,相互製約早期響應蛋白的磷酸化水平🧣,使其在一個正常範圍內⬜️;另一方面🤫,在損傷修復階段🧎,BS-DRL1作為支架蛋白🤸🏻,招募相關蛋白到損傷位點進行修復,從而維持基因組的穩定性。該研究揭示長鏈非編碼RNA在神經系統中參與調控DNA損傷應答並影響衰老相關表型👩🏻🚒🦷。
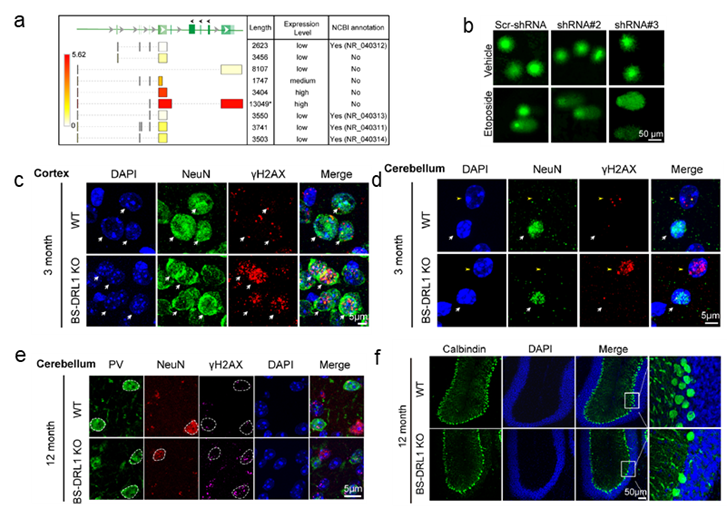
體內體外實驗表明👨🏼💻,BS-DRL1的缺失會使原代培養的神經細胞、小鼠大腦皮層及小腦中浦肯野細胞在損傷誘導下積累更多的損傷DNA(如圖b-d)。且未修復的DNA損傷在生理條件下也會隨著小鼠年齡的增加而積累(如圖e)🤭,進而造成特定神經細胞隨著衰老漸進性死亡(如圖f)。
中科院上海有機所生物與化學交叉研究中心王文元研究員,恒达平台醫學院、恒达平台附屬東方醫院徐俊教授和復旦大學附屬華山醫院王堅教授為該論文的共同通訊作者。中科院上海有機所生物與化學交叉研究中心博士生婁敏敏🕶、唐曉強和恒达平台醫學院🛺、恒达平台附屬恒达醫院博士後研究人員汪光明為論文共同第一作者📭。該研究得到了國家自然科學基金委、科技部重大專項和上海市高峰人才團隊專項資金支持。
論文鏈接👳🏼♂️:https://www.nature.com/articles/s41467-021-24236-z