附屬東方醫院劉中民團隊研究抗氧化納米酶工程化幹細胞用於體內示蹤及協同治療心梗,相關成果發表於《先進功能材料》
來源:醫學院
時間🌲🧑🏻🏭:2024-02-22 瀏覽👩🏼🏭:
2月14日,恒达平台附屬東方醫院劉中民教授/胡益輝副研究員/樂文俊副研究員和大連理工大學孫文教授合作🐩,在《先進功能材料》(Advanced Functional Materials)雜誌上發表了題為“Antioxidant Nanozyme-Engineered Mesenchymal Stem Cells for In Vivo MRI Tracking and Synergistic Therapy of Myocardial Infarction”的論文。該論文中,作者合成了兼具成像特性和ROS清除活性的多功能納米酶,通過細胞內吞作用,構建了工程化幹細胞,以實現幹細胞的體內跟蹤和心梗協同增效治療。

幹細胞優良的旁分泌作用🙎🏻♂️、免疫調節功能📌、抗炎性能雖然在心肌梗死(簡稱“心梗”)治療中已初見成效,但仍然存在兩個亟需解決的挑戰:一是心梗部高活性氧(ROS)、高氧化應激🫄、炎症等極端的微環境,導致幹細胞的存活率和駐留率低而療效有限🫲🏽;二是幹細胞的體內分布、遷移和歸巢不明確🎗,阻礙其臨床推廣應用。
納米酶是一類具有類酶催化活性的功能納米材料🫵🏿,兼具催化和納米材料的雙重功能😦,已廣泛應用於生物傳感、免疫分析、成像、疾病診療等領域。其中,高效清除ROS的抗氧化納米酶🧔🏼,已在細胞保護、抗衰老🧘🏻♂️、炎症、缺血性疾病👄、神經退行性疾病的治療中有著舉足輕重的地位👨🏿🎓。此外🎏,納米酶優良的光、熱💮、磁、聲等特性,賦予其成像功能🚴🏻♊️,可作為成像造影劑。因此,結合納米酶的催化活性和成像功能,構建抗氧化納米酶工程化幹細胞,用於幹細胞移植後的體內成像示蹤和清除ROS改善微環境協同治療心梗,具有重要的研究價值。
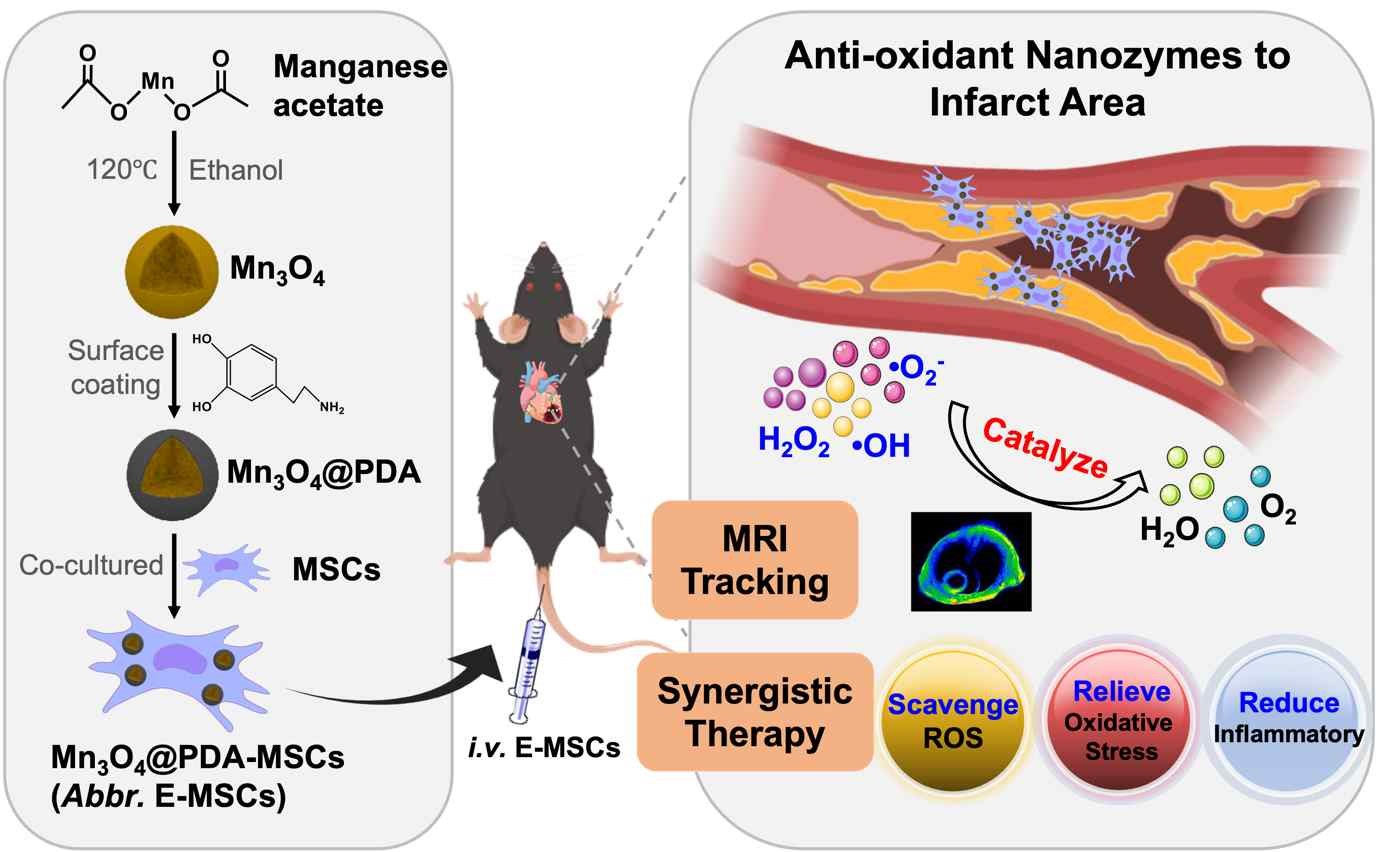
圖1 Mn3O4@PDA-MSCs的構建及其在體內的MRI示蹤和改善微環境增強心梗治療
作者通過聚合反應在Mn3O4納米酶的表面修飾了聚多巴胺(PDA)塗層,即為Mn3O4@PDA👩🏿🎤。PDA的修飾具有三個優點🧑🏽🦱:一是提高Mn3O4的生物相容性;二是增強SOD類酶催化活性;三是提升T1加權MRI示蹤性能👨🎓。在此基礎上,Mn3O4@PDA通過簡單溫和的內吞作用進入人臍帶間充質幹細胞(MSCs)的胞質內,形成Mn3O4@PDA-MSCs,即工程化幹細胞(簡稱E-MSCs)🐀。
體外研究發現與MSCs相比,E-MSCs的幹性、分化、遷移、抗氧化和抗炎等性能顯著增強🐜🪒。體內示蹤實驗表明移植24小時內E-MSCs在心梗部位的MIR信號明顯增強👩🚀,治療結果表明E-MSCs同時發揮了納米酶的抗氧化和抗炎作用以及MSCs的再生和血管生成功能,從而降低心梗小鼠的心肌纖維化,增強心功能。
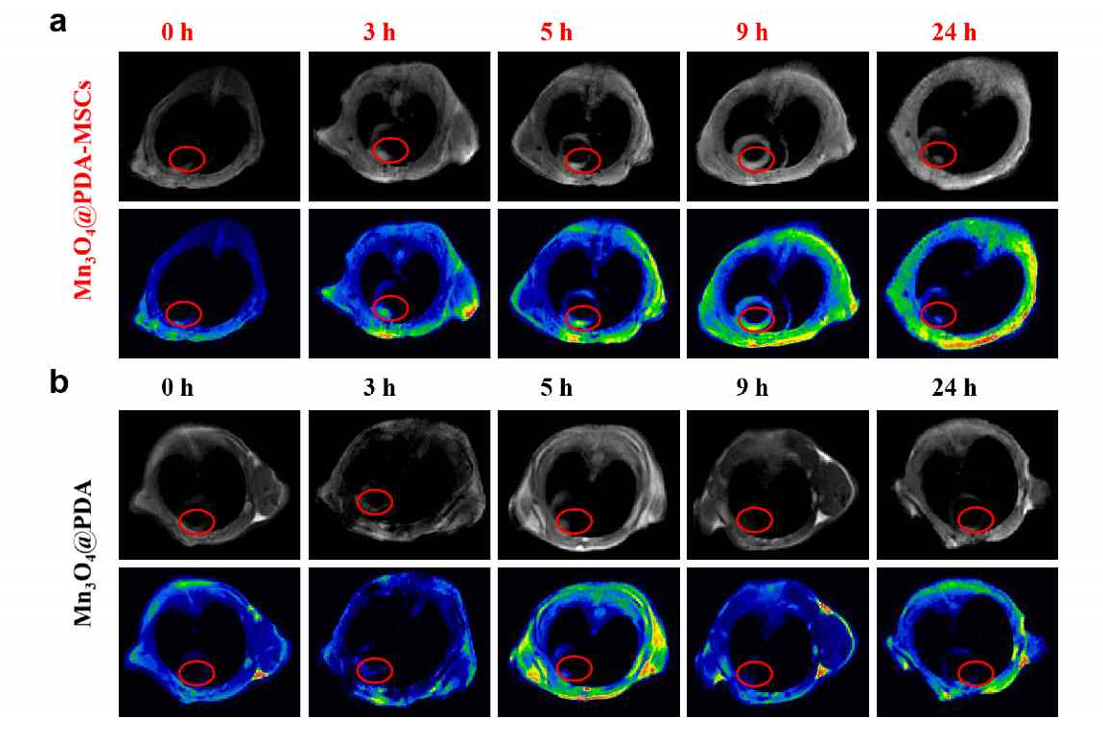
圖2 Mn3O4@PDA-MSCs及Mn3O4@PDA在體內的MRI成像
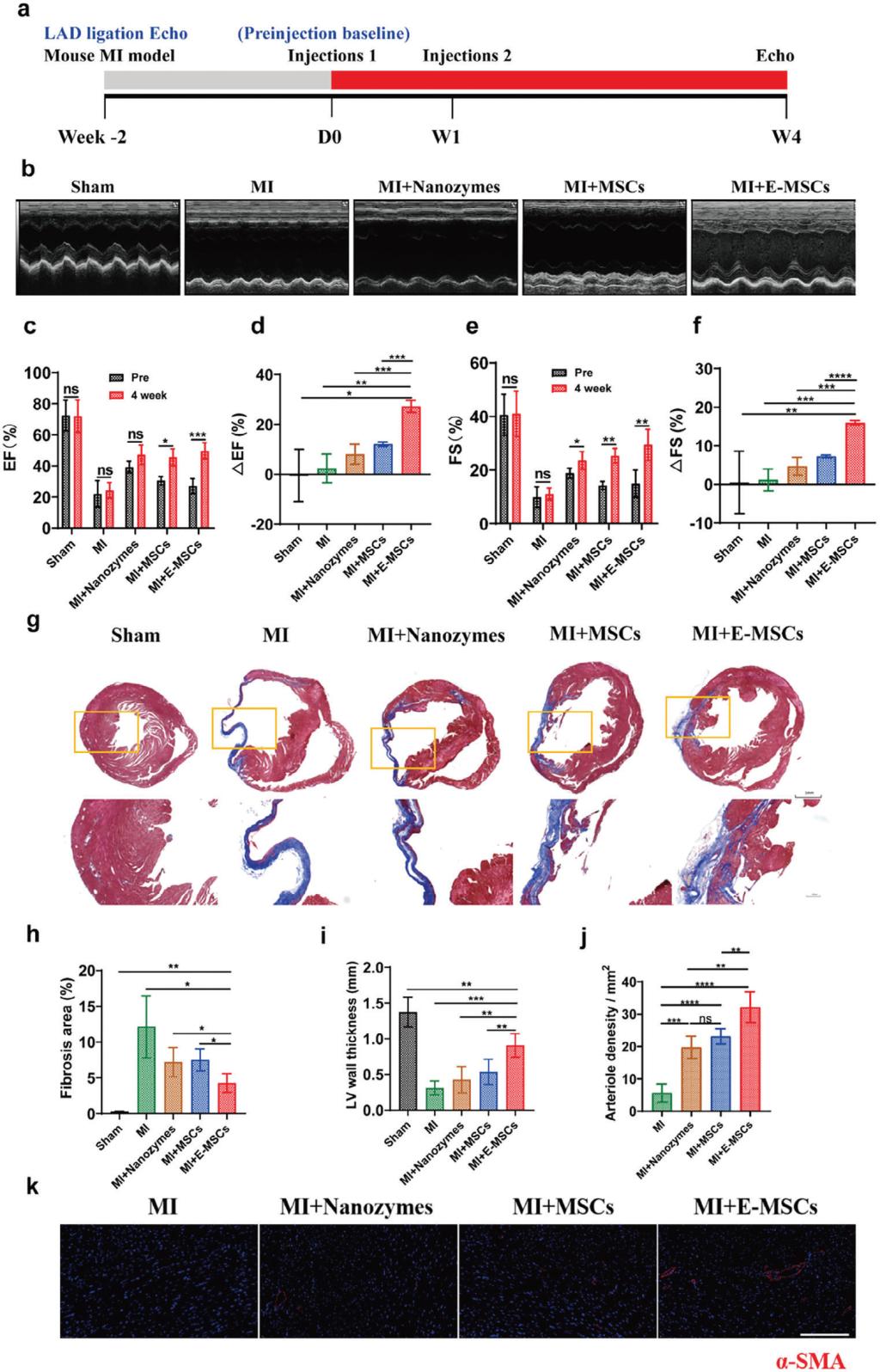
圖3 Mn3O4@PDA-MSCs👩🏻🏭、MSCs🚣♀️🚤、Mn3O4@PDA的體內心梗治療
該論文首次報道了抗氧化納米酶工程化幹細胞用於心梗部位示蹤和協調治療🐣。一方面,納米酶的T1加權特性🌞,可實現幹細胞的體內MRI示蹤☹️;另一方面,納米酶可改善心梗微環境(清除ROS、緩解氧化應激、降低炎症),提升幹細胞的活性,增強心梗治療☝️。論文中詳細研究了抗氧化納米酶的MRI示蹤和抗氧化🙅🏿♀️、抗炎💂♂️、遷移等性能,論述了E-MSCs的抗炎和促血管生成作用👷🏼♀️🪻,並應用於具有臨床研究意義的心梗治療研究🙎🏻♀️。該研究工作為實現幹細胞的體內示蹤和增強治療提供了新材料💁🏼、新策略。
恒达平台醫學院🔯、附屬東方醫院為該研究的第一通訊單位。恒达平台醫學院🫓、附屬東方醫院劉中民教授🧁、胡益輝副研究員和大連理工大學孫文教授為論文共同通訊作者。恒达平台附屬東方醫院副研究員樂文俊、碩士研究生孫澤藝和心外科副主任醫師李鐵巖為論文共同第一作者。另外🦐,恒达平台附屬東方醫院再生所馬騰副研究員、心衰所劉傑研究員、劉洋副研究員為研究提供了幫助。此外🏡,該研究受到國家自然科學基金項目、幹細胞與轉化IV類高峰學科項目及恒达平台自主原創基礎應用研究項目等支持👢。