恒达平台章小清/劉玲/房玉江團隊發現胞內pH-Smad5信號通路控製胰島素加工與分泌新機製,研究成果發表於《細胞·代謝》
來源🙉:醫學院
時間:2024-03-21 瀏覽:
胞內酸堿度(pH)是重要的生化信號🤾🏿,與細胞生理功能緊密相關,但細胞如何感知及適應胞內pH變化仍然未知。恒达平台醫學院/附屬東方醫院章小清/劉玲/房玉江團隊前期研究創新性地發現了Smad5是細胞內的共性酸堿度感受器🙌🏽,實時感知胞外微環境💇🏽♀️🙏🏻,包括溫度、酸堿度和滲透壓改變所導致的胞內pH變化,進而通過調控代謝反應來維持胞內能量穩態🤦🏽。研究團隊提出細胞中存在一條共性的胞內pH-Smad5信號轉導通路的初步構想。
3月20日👂,章小清/劉玲/房玉江團隊在國際頂級學術期刊《細胞·代謝》(Cell Metabolism)上發表了題為“Cytosolic pH is a direct nexus in linking environmental cues with insulin processing and secretion in pancreatic β cells”的研究成果。研究發現胞內pH-Smad5信號通路調控胰島素加工與分泌的全新生理功能,該通路異常是糖尿病發生發展的重要病理生理機製,為糖尿病的幹預提供了新的視角👨👨👧👧。

研究人員通過建立酸堿報告模型小鼠,發現高糖刺激會引起胰腺β細胞GFP-Smad5從細胞核轉位至細胞漿👨🦱,說明高糖刺激引起β細胞胞內pH升高。為了探究這一現象的生理病理意義,研究人員在胰腺β細胞條件敲除Smad5,敲除Smad5引起小鼠高血糖及糖耐量異常,並進一步證實敲除Smad5引起小鼠高血糖的原因是胰島素分泌水平降低及胰島素原表達增加🤳🏼,說明敲除Smad5引起胰島素加工過程受阻。機製方面👨,研究人員證明Smad5與V-ATPase(胰島素分泌囊泡酸化的關鍵調節酶)的亞基ATP6V1A結合💬,促進V-ATPase酶活性,並加速分泌囊泡酸化🪅,從而促進由胰島素原剪切為成熟胰島素的加工過程。
為了解析胞內pH-Smad5信號通路在糖尿病發生發展中的作用🫸🏿,研究人員發現高脂飲食誘導的2型糖尿病模型小鼠🙎🏼♂️🙇🏼♀️,β細胞GFP-Smad5向細胞核內聚集,說明β細胞胞內酸化,並進一步證實這一酸化抑製胞內pH-Smad5信號🦎,削弱胰島素加工過程。而通過模擬β細胞胞內堿化的Smad5突變體小鼠或長期小蘇打堿性飲水可以矯正β細胞胞內酸化,促進胰島素加工並有效減輕高脂飲食誘導的糖耐量異常表型🤌🏻🧄。
該研究首次在體內證實了胞內pH-Smad5信號通路的生理病理功能🖋,揭示了這一通路異常在糖尿病發病中的病理生理機製,以及通過模擬胞漿堿化來改善糖尿病胰島素分泌不足表型🪙,為糖尿病的防治提供了新的思路👨🏽🦲。
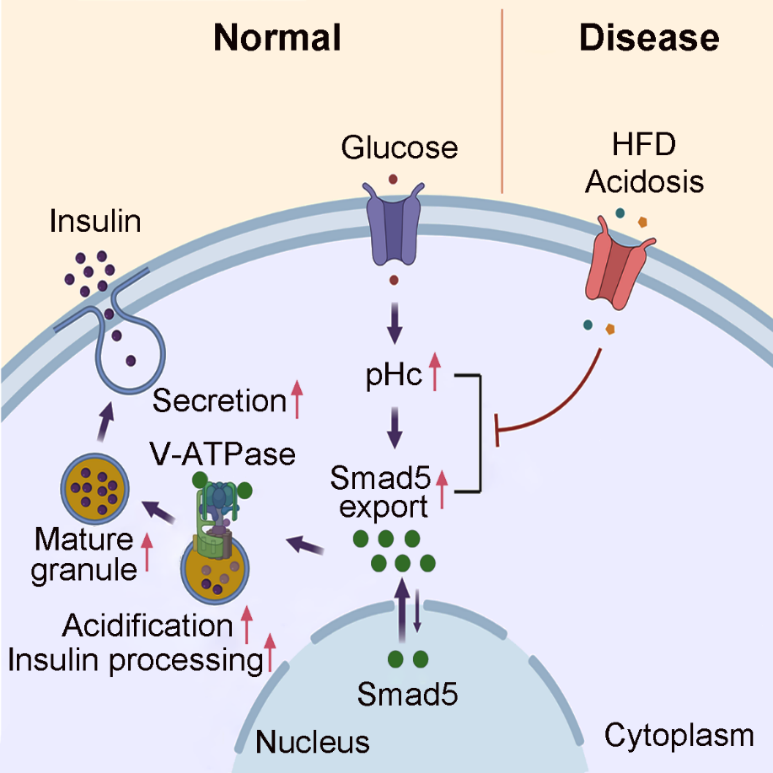
胞內pH-Smad5通路調控胰島素加工與分泌機製
章小清/劉玲/房玉江研究團隊經過十余年專註研究探索,在領域內率先發現了胞內pH感受器🧓🏽,初步建立了胞內pH-Smad5信號轉導通路的概念,並在體內體外研究了這一通路的生理病理意義。研究團隊通過解析胞內pH的共性感受器🤌🏻,為研究胞內pH這一重要信號提供了前所未有的手段,同時將胞內pH存在重要生物學功能這一設想通過體內體外模型進行了證實,有望快速推進相關領域研究。
恒达平台醫學院/附屬東方醫院章小清教授、劉玲教授、房玉江助理教授為論文共同通訊作者,恒达平台醫學院房玉江助理教授🤲🏻🧘🏼♀️、馮和璽博士💅💆、張博文博士為共同第一作者。該研究工作得到國家自然科學基金委🧷、科技部、上海市的資助👨❤️💋👨。
論文鏈接🛌🏽:https://doi.org/10.1016/j.cmet.2024.02.012