醫學院張青鋒課題組研究成果發表於《美國科學院院報》👷🏻♂️,揭示表觀轉錄組調控瘧疾傳播的新機製
來源👧🏿:醫學院
時間:2022-03-03 瀏覽🍌:
2月25日,我校醫學院👗、附屬恒达醫院教授張青鋒課題組聯合生命科學與技術學院江賜忠🚍、廈門大學袁晶及美國國立衛生院Thomas Wellems等團隊在《美國科學院院報》(PNAS)上發表了題為“5-methylcytosine modification by Plasmodium NSUN2 stabilizes mRNA and mediates the development of gametocytes”的研究性論著💅🏼,首次揭示了表觀轉錄組調控瘧原蟲配子生殖的表觀遺傳調控新機製,鑒定了新調控因子NSUN2並闡明其作用機製,為瘧疾傳播阻斷新措施的研發提供了新靶點。

瘧疾(malaria)是由瘧原蟲感染引起的寄生蟲病,與艾滋病、結核病並列全球三大傳染病之一,全球有近90個國家和地區存在瘧疾流行⇾,每年約2.4億人感染🧗♂️,導致約60多萬人死亡。我國雖然實現了消除瘧疾目標🈹,但目前仍有大量境外輸入病例,如何防止輸入再傳播是鞏固我國消除瘧疾成果的關鍵🙅🏿。瘧原蟲的生活史需要經歷人和按蚊兩個宿主,只有成熟的配子體才能通過按蚊傳播。因此🛅,瘧原蟲的配子生殖過程🕵🏻,即在人體內紅細胞寄生階段的無性體向配子體的性分化和發育⚡️👮♀️,是瘧原蟲感染按蚊的關鍵,也是瘧疾傳播的決定性環節。在之前的研究中,張青鋒課題組已從轉錄水平和轉錄後水平分別揭示了兩條調控瘧原蟲配子生殖的表觀遺傳調控途徑:一是轉錄抑製因子AP2-G5與轉錄激活AP2-G協同調控整個配子生殖過程,包括性分化與性發育,直至成熟配子體的產生🏟;二是RNA降解酶如RNase II和Rrp6等通過實時降解靶基因的新生RNA,調控配子生殖過程的啟動(性分化)🐍。但是,對於表觀轉錄組是否參與調控瘧原蟲配子生殖🗞,目前尚不清楚👨🏻🦼。
在此次研究中🧞♂️,課題組首先利用定量質譜、BisSeq等技術🚵🏼♀️,在單核苷酸水平上繪製了鼠瘧原蟲與人瘧原蟲不同發育階段(無性期和配子體期)的mRNA m5C甲基化修飾的全基因組圖譜。相對於豐富較高的m6A甲基化修飾👨🏼🎓,瘧原蟲轉錄組中的m5C修飾水平較低🍫,靶基因也相對較少💊🏈,提示這種修飾可能具有更為特異的生物學功能✊👩🏿💻。隨後,通過轉錄組和蛋白表達組分析發現🎫,m5C修飾的mRNA具有更長的半衰期,其蛋白質水平也更高。這表明m5C修飾與瘧原蟲轉錄本的穩定性及翻譯水平具有正相關性,能夠在轉錄後水平上對瘧原蟲的基因表達水平進行矯正🧘🏽♀️,從而實現不同基因的階段特異性表達⏭。
值得關註的是,課題組通過對m5C靶向基因的功能聚類分析🤸🏼,發現m5C修飾的生物學功能指向瘧原蟲的有性生殖過程。在約氏瘧原蟲和惡性瘧原蟲基因組中,各有4個m5C甲基轉移酶候選基因,即Pynsun1~4及Pfnsun1~4,但是不清楚誰是負責催化mRNA m5C甲基化修飾的關鍵基因。為此,課題組通過CRISPR-Cas9基因編輯技術對這些候選酶基因展開了基因敲除工作,最終獲得了Pynsun1⚠️🙎🏻♂️、Pynsun2及Pfnsun2等基因敲除蟲株。通過表型分析發現⏮,Pynsun2_KO與Pfnsun2_KO皆基本喪失了配子生殖能力🦀,而且這種功能缺陷能夠通過基因修復而得以恢復。進一步的機製研究發現:NSUN2蛋白是瘧原蟲中負責mRNA m5C修飾的關鍵甲基轉移酶🤦🏻♂️🧙,它的缺失直接影響瘧原蟲配子體發育相關的靶基因轉錄本m5C修飾水平,使瘧原蟲產生成熟配子體的能力明顯下降;並在感染蚊子後🔃,各個有性期發育階段的蟲體數量也顯著下降🍈,包括最終能夠感染人的子孢子階段🏄,最終嚴重影響了瘧疾傳播的效率🗽。
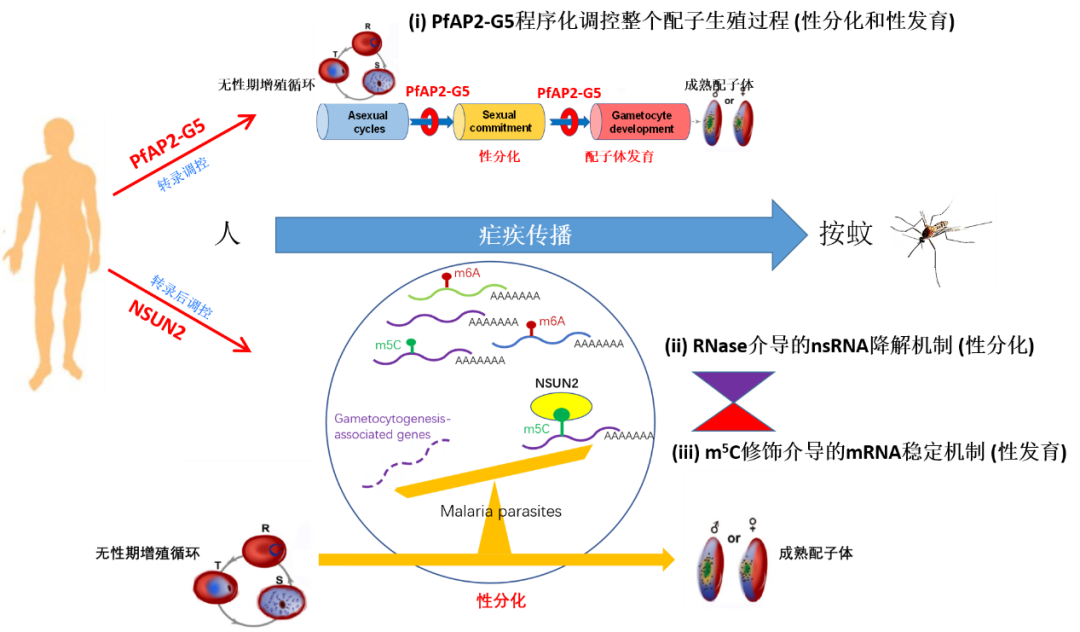
該研究通過表觀轉錄組組學分析,結合瘧原蟲基因功能研究,首次繪製了瘧原蟲m5C甲基化修飾為標誌的表觀轉錄組圖譜🦃🧯,並揭示了這種轉錄後修飾對瘧原蟲有性生殖的調控作用及機製,不僅為全面理解瘧原蟲有性生殖調控機製提供了新的理論,而且為阻斷瘧疾阻斷的新藥或疫苗研製提供了一個新靶點。
原文鏈接🔗:https://doi.org/10.1073/pnas.2110713119