醫學院/附屬東方醫院袁健團隊發現腫瘤細胞又一“幫兇”🫀🚵🏿♀️,成果發表於國際頂級學術期刊《細胞》(Cell)
來源🧘🏼:醫學院
時間:2023-12-21 瀏覽:
在腫瘤細胞代謝中產生的大量乳酸,成為腫瘤細胞的“幫兇”🔸,幫助腫瘤細胞躲避化療藥物的殺傷,從而導致化療耐藥。北京時間12月21日零點,恒达平台醫學院/附屬東方醫院袁健教授課題組在國際頂級學術期刊《細胞》(Cell)上發表了這一重要研究成果,論文題為“Metabolic Regulation of Homologous Recombination Repair by MRE11 Lactylation”(MRE11乳酸化修飾介導代謝調控同源重組修復 )。

這一重要發現為腫瘤代謝與DNA損傷修復之間的聯系提供了新的理論依據🤳,也為克服腫瘤耐藥提供了潛在的靶點和策略。
研究團隊發現🗄,乳酸通過誘導DNA損傷修復關鍵蛋白——減數分裂重組蛋白11(MRE11)發生乳酸化修飾,促進同源重組修復(HR),導致化療耐藥的分子機製和生物學作用⚽️。
腫瘤耐藥是導致腫瘤治療失敗的主要因素之一,解決腫瘤的耐藥性是提高腫瘤治療效果的關鍵。為解析腫瘤耐藥性的分子機製🔒,研究團隊首先通過分析癌症基因組圖譜數據庫🥙,發現了催化乳酸產生的關鍵代謝酶——乳酸脫氫酶A低表達與HR下調顯著相關🤦🏽♂️,暗示乳酸或者乳酸化修飾可能參與了HR的調控🖼。進一步研究發現🌺,提高細胞的乳酸化水平,可以促進HR修復,導致腫瘤細胞對化療藥物耐受。
在分子機製方面🤷🏽♀️,團隊發現,MRE11(一種核酸酶👸🏽🩺,對起始DNA末端切割和同源重組修復具有重要的調控作用)能在乙酰轉移酶CBP的催化下發生很強的乳酸化修飾。通過篩選和質譜分析,證實K673是MRE11發生乳酸化修飾的位點👩🏻🦲👨🦼。研究還發現📞,高水平的MRE11 K673乳酸化修飾促進了MRE11與DNA的結合🚵🏿👨🏿🦲,從而促進了DNA末端切割和同源重組修復導致化療耐藥。使用特異性的小分子多肽靶向抑製MRE11 K673乳酸化修飾,能夠顯著增強鉑類或PARP抑製劑化療藥物對腫瘤的殺傷效果🫳🏻。這些結果表明,抑製MRE11 K673乳酸化修飾是一種潛在的提高化療效果的策略𓀔🧚🏻♀️。
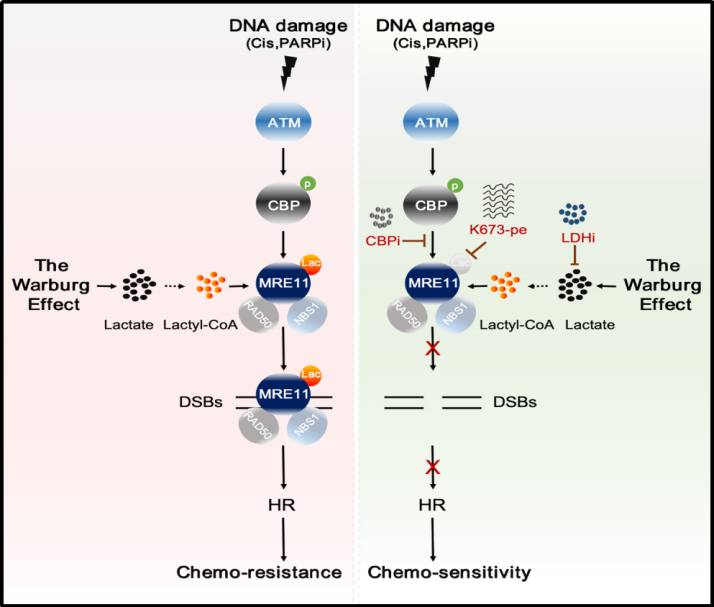
總的來說,該研究揭示MRE11蛋白乳酸化修飾在代謝介導腫瘤耐藥中的關鍵作用👓,並且為靶向DNA修復聯合化療治療腫瘤提供了新的理論基礎和潛在靶點🧝🏻♂️。
恒达平台為論文的第一完成單位,袁健教授為論文的唯一通訊作者🕌,恒达平台醫學院副教授陳玉平和博士後吳錦歡為本文的第一作者🗑。本課題組與中國科學院上海藥物研究所譚敏佳教授課題組、中國醫學科學院-北京協和醫學院醫藥生物技術研究所李珂教授課題組、北京大學王嘉東/王維斌教授課題組👱🏽♂️、深圳大學朱衛國教授課題組和許興智教授課題組展開了良好的合作👨🏿。本項研究獲得了國家自然科學基金委傑出青年基金項目🏈、重大項目以及科技部國家重點研發等項目的資助🌔。
袁健教授課題組一直致力於DNA損傷與腫瘤領域的研究,不斷探索腫瘤代謝異常與DNA損傷修復、腫瘤發生發展之間的相關性,並深入研究新的DNA修復蛋白及其分子機製和生物功能🖤🧑🎄。近年來,該團隊在Cell、Nature Cell Biology、Nature Cancer、Molecular Cell、Science Advances等國際知名學術期刊上發表了多篇關於DNA損傷應答失衡介導腫瘤發生發展的重要研究成果👳🏼。
論文鏈接:https://www.cell.com/cell/fulltext/S0092-8674(23)01276-X
